Δείτε αναλυτικά ποια σκευάσματα ανακαλούνται - Η ανάκληση είναι εθελοντική και γίνεται προληπτικά μετά την παγκόσμια ανησυχία για την ουσία ρανιτιδίνη που περιέχει τη δυνητικά καρκινογόνο πρόσμιξη NDMA
Στην ανάκληση του φαρμάκου ZANTAC και των γενόσημων, προχωρά ο Ελληνικός Οργανισμός Φαρμάκου.
Συγκεκριμένα, σε ό,τι αφορά στο ZANTAC ανακαλούνται όλες οι παρτίδες του:
ZANTAC EF.TAB 150MG/TAB,
ZANTAC F.C.TAB 150MG/TAB
ZANTAC INJ.SOL 50MG/2ML AMP,
κατόπιν της αναστολής του πιστοποιητικού καταλληλότητας του παραγωγού Saraca Laboratories Limited για τη δραστική ουσία ρανιτιδίνη.
Η ανάκληση είναι εθελοντική και γίνεται προληπτικά εκ μέρους της καθώς και της εταιρείας GLAXOSMITHKLINE AEBE για το σύνολο των προϊόντων ZANTAC, ακόμη και στην περίπτωση παρτίδων από άλλον παραγωγό δραστικής ουσίας (Dr. Reddy’s Limited ).
Η εταιρεία GLAXOSMITHKLINE AEBE ως κάτοχος άδειας κυκλοφορίας των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα.
Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Αναφορικά με το προϊόν RANITIDINE της MYLAN, ανακαλούνται τα ακόλουθα:
RANTIDINE/MYLAN 150MG F.C. TAB K110115A 9/2019
RANTIDINE/MYLAN 150MG F.C. TAB K110116A 3/2019
RANTIDINE/MYLAN 150MG F.C. TAB K110216A 5/2019
Σύμφωνα με σχετική ανακοίνωση του ΕΟΦ, η απόφαση αποτελεί «προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας με σκοπό να ενισχύσει την εθελοντική ανάκληση στην οποία προβαίνει η εταιρεία, κατόπιν της αναστολής του πιστοποιητικού καταλληλότητας του παραγωγού Saraca Laboratories Limited για τη δραστική ουσία ρανιτιδίνη».
Η εταιρεία GENERICS PHARMA HELLAS ΕΠΕ ως τοπικός αντιπρόσωπος των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα. Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Σε ανάκληση όλων των παρτίδων του Ponstan σε υγρή μορφή, προχώρησε η εταιρεία PFIZER.
Συγκεκριμένα, πρόκειται για όλες οι παρτίδες του πόσιμου εναιωρήματος PONSTAN 50mg/5ml 125ml.
Αυτή η απόφαση πάρθηκε προληπτικά λόγω της πιθανότητας να υπερβαίνει τα νέα επιτρεπόμενα όρια ημερήσιας έκθεσης για τις στοιχειακές προσμίξεις μολύβδου και λιθίου σύμφωνα με την πιο αυστηρή ευρωπαϊκή οδηγία ICH Q3D.
Η ανάκληση δεν αφορά τις υπόλοιπες φαρμακοτεχνικές μορφές του προϊόντος.
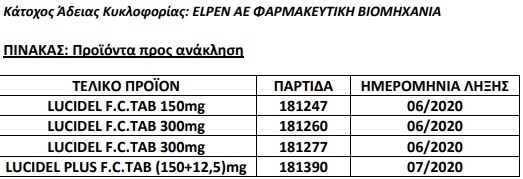
ΕΟΦ: Την ανάκληση συγκεκριμένων παρτίδων (βλ. συνημμένο Πίνακα) των φαρμακευτικών προϊόντων LUCIDEL 150 mg, LUCIDEL 300 mg και LUCIDEL PLUS (150+12,5) mg.
Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας με σκοπό να ενισχύσει την εθελοντική ανάκληση στην οποία προβαίνει η εταιρεία ELPEN, κατόπιν ανίχνευσης στη δραστική ουσία ιρβεσαρτάνη της ουσίας NDEA (πιθανός καρκινογόνος παράγοντας) σε επίπεδα άνω των επιτρεπτών ορίων.
Η εταιρεία ELPEN ως κάτοχος άδειας κυκλοφορίας των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα. Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Το Lucidel ενδείκνυται για χρήση σε ενήλικες για τη θεραπεία της ιδιοπαθούς υπέρτασης. Ενδείκνυται επίσης για τη θεραπεία της νεφροπάθειας σε ενήλικες ασθενείς με αρτηριακή υπέρταση και σακχαρώδη διαβήτη.
Σε ανάκληση παρτίδας γνωστού φαρμάκου λόγω διαρροής προχώρησε ο ΕΟΦ.
Στην ανάκληση των παρτίδων 801583 (ημερ. λήξης 03/2020), 801830 (ημερ. λήξης 06/2020) και 270714 (ημερ. λήξης 02/2019) του φαρμακευτικού προϊόντος ΄΄BOTAFEX CUT.SOL 2%, προχώρησε διότι:
▪ Τα αποτελέσματα του μακροσκοπικού ελέγχου στοιχειώδους συσκευασίας που έγιναν στην παρτίδα 270714, δεν συμφωνούν με τις προδιαγραφές του προϊόντος λόγω προβλήματος διαρροής.
▪ Τα αποτελέσματα του ελέγχου απελευθερούμενης δόσης που έγιναν στις παρτίδες 801583, 801830 και 270714, δεν συμφωνούν με τις προδιαγραφές του προϊόντος.
Η εταιρεία ΦΑΡΜΕΞ Α.Ε. οφείλει να επικοινωνήσει άμεσα με τους αποδέκτες των συγκεκριμένων παρτίδων και να τις αποσύρει από την αγορά μέσα σε εύλογο χρονικό διάστημα.
Τα σχετικά παραστατικά τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.



























