Χιλιάδες αγωγές κατά του Zantac, το οποίο χορηγείται για την αντιμετώπιση γαστροοισοφαγικής παλινδρόμησης, δυσπεψίας, έλκους και άλλων περιπτώσεων, έχουν γίνει από καταγγέλλοντες ότι το γνωστό φάρμακο ευθύνεται για εμφάνιση καρκίνου.
Στις 13 Νοεμβρίου έχει οριστεί η πρώτη δίκη στις ΗΠΑ σχετικά με τους ισχυρισμούς ότι το Zantac προκαλεί καρκίνο, δήλωσε χθες Παρασκευή (30.6.2023) δικηγόρος των εναγόντων, οι οποίοι υποστηρίζουν ότι μπορεί να ευθύνεται για 9 μορφές όγκου, συμπεριλαμβανομένων του παχέος εντέρου, του μαστού και της ουροδόχου κύστης.
Η έκβαση της δίκης αναμένεται με μεγάλο ενδιαφέρον, αφού θα φανεί κατά πόσο τεκμηριώνονται επιστημονικά οι ισχυρισμοί των εναγόντων, ενώ ενδεχομένως να αποτελέσει σημείο αναφοράς για μελλοντικές διευθετήσεις.
Αφότου έλαβε έγκριση το 1983, το Zantac έγινε μέσα σε πέντε χρόνια το πιο διαδεδομένο σκεύασμα παγκοσμίως και ένα από τα πρώτα που ξεπέρασαν το 1 δισεκατομμύριο δολάρια σε πωλήσεις ετησίως.
To 2019 ορισμένες από τις παρασκευάστριες εταιρίες διέκοψαν την παραγωγή Zantac λόγω ανησυχίας ότι η δραστική ουσία ρανιτιδίνη μπορεί με την πάροδο του χρόνου να παράγει Ν-νιτροζοδιμεθυλαμίνη (NDMA) ως αποτέλεσμα αποσύνθεσης.
Παρότι η NDMA εμφανίζεται σε χαμηλά επίπεδα σε τρόφιμα και νερό, η έρευνα κατέδειξε ότι σε μεγαλύτερες ποσότητες μπορεί να προκαλέσει καρκίνο.
Ο αμερικανικός Οργανισμός Τροφίμων και Φαρμάκων (FDA) απέσυρε το 2020 από την αγορά το φάρμακο Zantac και τα γενόσημά του.
Οι φαρμακοβιομηχανίες δικαιώθηκαν τον Δεκέμβριο από ομοσπονδιακό δικαστή που απέρριψε όλες τις αγωγές (περίπου 50.000) που είχαν κατατεθεί σε ομοσπονδιακό δικαστήριο των ΗΠΑ, με το σκεπτικό ότι οι ισχυρισμοί που συνδέουν το Zantac με εμφάνιση καρκίνου δεν τεκμηριώνονται επαρκώς επιστημονικά.
Οι υπόλοιπες αγωγές έχουν κατατεθεί σε πολιτειακά δικαστήρια, οι περισσότερες στο Ντέλαγουερ, όπου εκκρεμούν πάνω από 70.000 υποθέσεις.
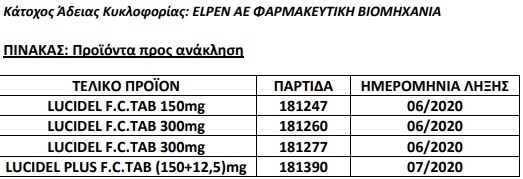
ΕΟΦ: Την ανάκληση συγκεκριμένων παρτίδων (βλ. συνημμένο Πίνακα) των φαρμακευτικών προϊόντων LUCIDEL 150 mg, LUCIDEL 300 mg και LUCIDEL PLUS (150+12,5) mg.
Η παρούσα απόφαση αποτελεί προληπτικό μέτρο για την προάσπιση της Δημόσιας Υγείας με σκοπό να ενισχύσει την εθελοντική ανάκληση στην οποία προβαίνει η εταιρεία ELPEN, κατόπιν ανίχνευσης στη δραστική ουσία ιρβεσαρτάνη της ουσίας NDEA (πιθανός καρκινογόνος παράγοντας) σε επίπεδα άνω των επιτρεπτών ορίων.
Η εταιρεία ELPEN ως κάτοχος άδειας κυκλοφορίας των προϊόντων, οφείλει να υλοποιήσει την ανάκληση σε εύλογο χρονικό διάστημα. Τα παραστατικά της ανάκλησης πρέπει να τηρούνται για διάστημα τουλάχιστον πέντε (5) ετών και να τίθενται υπόψη του ΕΟΦ, εφόσον ζητηθούν.
Το Lucidel ενδείκνυται για χρήση σε ενήλικες για τη θεραπεία της ιδιοπαθούς υπέρτασης. Ενδείκνυται επίσης για τη θεραπεία της νεφροπάθειας σε ενήλικες ασθενείς με αρτηριακή υπέρταση και σακχαρώδη διαβήτη.
O ΕΟΦ ανακοίνωσε την απαγόρευση διακίνησης και διάθεσης του συμπληρώματος διατροφής Horny Goat Weed Extract